Mitochondrial Epilepsy, a Challenge for Neurologists. Int J Mol Sci. 2022
【ミトコンドリアてんかんをどのように想起するか?】
てんかん症候は多様
ミオクロニー発作や重篤なてんかん性脳症があれば, ミトコンドリア病を疑うという認識は誤り
したがって, ミトコンドリアてんかんの診断は経験豊富な神経内科医にとっても困難
まずは家族歴を問うべき
特に低身長, 糖尿病, 片頭痛, 難聴, 運動失調, てんかん, 運動不耐性, 心筋症, 精神疾患など, 家族内で軽微かつ一見非特異的な兆候(レッドフラグ)には注意を払う
明らかに母方の家族歴が陽性であれば, mtDNA関連疾患が示唆
家族歴にかかわらず, 2つ以上の臓器に病変がみられる患者では, 原発性ミトコンドリア疾患を疑うべき
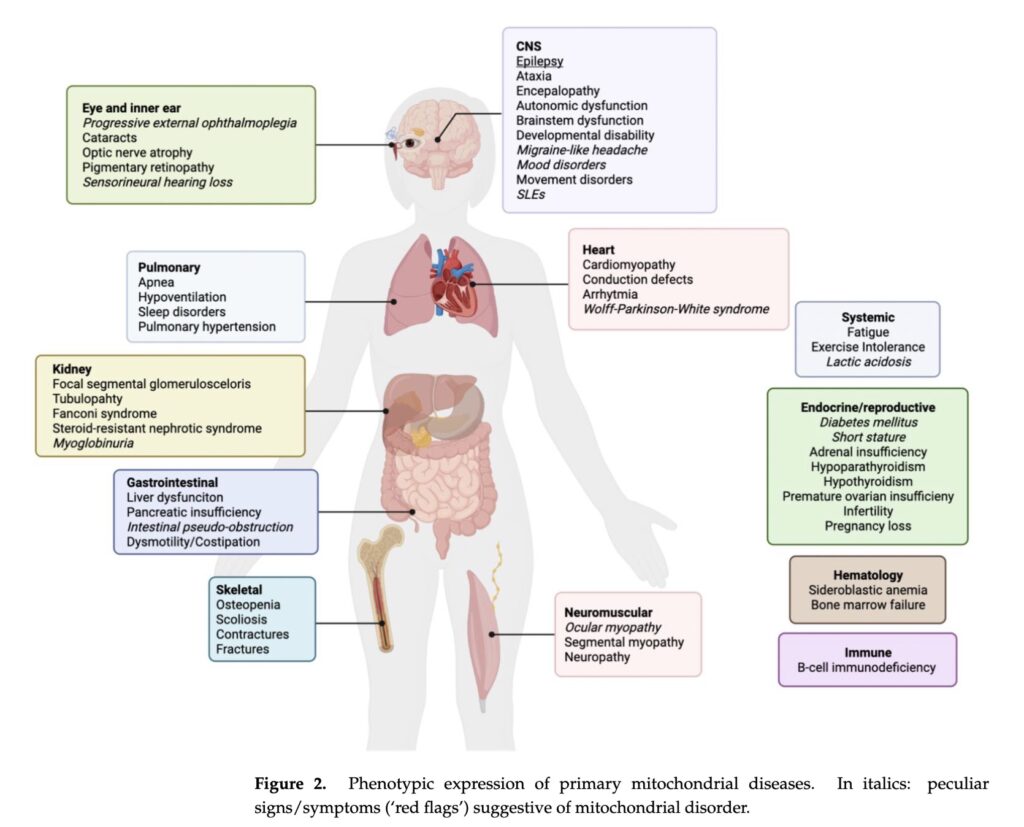
原発性ミトコンドリア疾患の表現型
イタリック体:ミトコンドリア疾患を示唆する特異な兆候/症状(「危険信号」)
【ポイント】
てんかん重積状態, 特に持続性部分てんかんは, MELAS症候群またはPOLG関連疾患によく伴う脳卒中様発作の疑いがある
脳波は疾患に特有のものではないが, 一般的に異常な背景活動の形で現れ, 典型的には後頭部への偏在を示す
てんかん発作の既往歴がある患者は, 脳MRI異常(皮質/皮質下萎縮, 脳卒中様病変, 基底核および白質の信号変化)および血清乳酸値の上昇率が高い
早期発症てんかんの場合, m.8993T > G(MILS変異)の検査を行うべき
ミオクロニー発作のある患者は, 特に神経筋疾患(ミオパチーや運動失調)を患っている場合, m.8344A > G(MERRF変異)の診断検査が必要となる可能性が高くなる
てんかん重積状態の既往, または難聴, 低身長, 内分泌疾患, 片頭痛を伴う発作がある場合は, まずm.3243A > G(MELAS変異)のスクリーニングを行う必要がある
原発性ミトコンドリア病の可能性が高い場合で, 最も一般的なmtDNA点変異の血液検査が陰性の場合, 筋肉など別の組織でmtDNAを評価する必要がある
特にMELASが疑われる場合は, 尿中のヘテロプラスミー分析が役立つことがある
【特徴】
有病率は4,300人に1人
ミトコンドリアてんかんの主な遺伝学的原因は, ミトコンドリアDNAおよび核コード化遺伝子POLGの変異
小児期または成人期に発症する可能性がある.
単一臓器または複数臓器・器官系に及ぶ
表現型の発現は発症年齢によって異なる
成人では, 通常, 末梢神経系および中枢神経系の様々な障害を伴うミオパチーの徴候が現れる
乳児では, 複雑な多臓器疾患, 重篤な脳筋症または心筋症を伴う孤立性ミオパチーにおいて, 精神運動遅滞, 筋緊張低下, 乳酸アシドーシス, 心肺機能不全を呈することがよくある
【ミトコンドリア病におけるてんかん】
約20~50%の患者は, 経過中に発作を経験する
あらゆる種類の発作が起こり得るが, 最も一般的な発作はミオクローヌス, 二次性全般化を伴う焦点性運動発作, 全般性強直間代発作
発作の病態は発症年齢によって異なる
早期発症てんかんは, 病気の経過中に原因不明の発作やスパズム, 強直発作を呈する確率が高い
成人発症は, ミオクローヌスを呈する確率が高い
ミトコンドリア病患者は, 非けいれん性または焦点性運動発作のいずれかのてんかん重積状態を経験する可能性がある
ミトコンドリア病におけるてんかん重積状態の有病率は不明
通常は脳卒中様発作と併存
【脳波】
特徴的な脳波(EEG)所見はない
患者の約90%では, びまん性または局所性の特異的な異常背景活動が認められる
これらの所見は, 早期発症てんかん患者でより一般的
てんかん性異常は, 最も一般的には後側頭葉, 頭頂葉, 後頭葉に局在
脳MRI異常(主にT2高信号と拡散制限)は頭頂後頭葉に多く見られ, 多くの場合EEG所見と一致する
【表現型と遺伝子型】
一般に, 遺伝子型と表現型の関係は絶対的ではなく, 症候群間にかなりの重複がある

ミトコンドリアてんかんと関連する遺伝子欠陥と表現型
MEMSA:ミオクローヌスてんかん性ミオパチー感覚性運動失調症
ANS:運動失調性神経障害スペクトラム
MDS:mtDNA枯渇症候群
NAS:その他特定なし
【メカニズム】
ATP枯渇が発作を発生
ミトコンドリア代謝の欠陥は, さまざまなメカニズムを通じて過剰な細胞興奮を引き起こす
また一部の遺伝子欠損がてんかんを引き起こす
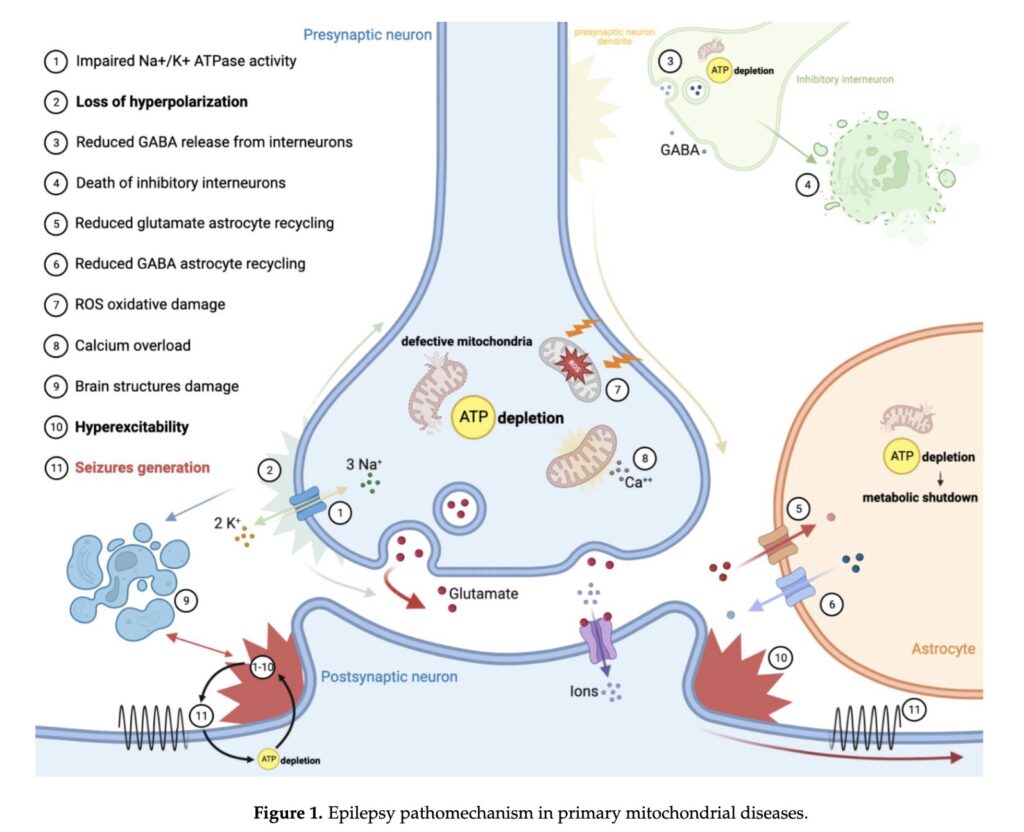
原発性ミトコンドリア疾患におけるてんかん発症メカニズム
ATPの枯渇により脳構造が損傷し, てんかん焦点が形成される可能性
ミトコンドリア機能不全によりカルシウムサイクルが損なわれ, ニューロンが損傷を受ける可能性
反応性グリオーシス, 脂質過酸化, mtDNA 損傷
【ミトコンドリア脳症, 乳酸アシドーシスおよび脳卒中様発作—MELAS】
MELAS症候群は, てんかん発作および/または認知症を伴う脳症, 乳酸アシドーシスを伴うミトコンドリアミオパチー, 脳卒中様発作を特徴とする多臓器疾
典型的には40歳未満で発症
ミトコンドリアDNAにおける多数の変異によって引き起こされる
m.3243A > G点変異が最も多い(患者の約80%)
m.13513G > A点変異は2番目に多い
英国コホートでは, この変異を有する患者の34.9%がてんかんを発症
MELAS におけるてんかんは多様
てんかん発作の発症年齢は0.5歳から57歳までで, 平均は22.6歳
最も多く報告されたのは焦点発作(間代発作と強直発作)
次いで全般強直間代発作
頻度は低いがミオクロニー発作も報告
脳卒中様発作はMELASの臨床的特徴
通常40歳未満で発症し患者の84~99%に発症
急性期には可逆性失語症, 運動障害, 皮質盲などの局所神経学的欠損を伴い, 急性脳卒中と類似することがある
これらの発作は, 二次性脳症を伴う局所性てんかん重積状態の一種として概念化されている
脳MRIで血管領域に一致しない脳卒中様病変
通常, 後脳の皮質および皮質下白質
視床やその他の深部脳灰白質構造も侵される可能性がある
脳卒中様病変は通常, 時間の経過とともに皮質の隣接領域に移動する
血管拡張が明らかになることがある
【赤色線維を伴うミオクロニーてんかん(MERRF)】
母性遺伝性のミトコンドリア脳筋症
通常は, 小児期または成人初期に発症
緩徐に進行するが, 青年期では急速に進行し致死的な結果に至ることもある
死亡年齢は7歳から79歳と幅広い
患者の80%に家族歴 (家族間で表現型が大きく異なる)
MERRF患者の75%以上はm.8344A > G変異
10万人あたり0.39人から10万人あたり1.5人の範囲
m.8356T > Cおよびm.8361G > Aも病原性があると認識
ミオパチー(赤色ぼろ線維を伴う)と進行性ミオクローヌスてんかんが重要な特徴
ミオクローヌスは持続性または間欠性の場合がある
通常, 光感受性があり, 刺激や書字, 食事などの動作によって増悪
MERRFのミオクローヌスは, 延髄小脳機能不全によっても生じる可能性がある
ほとんどの患者は, 全般性強直間代発作
一部の患者は脱力発作や欠神発作を呈し, 焦点発作の報告もある
これまでの研究ではm.8344A > G mtDNA変異の表現型の多様性が分析
小脳性運動失調, 認知症, 感音難聴, 多発性皮膚脂肪腫などが含まれる
ミオクローヌスは, 全般発作よりも運動失調に関連することが多い
皮質ミオクローヌスの発症に小脳が重要な役割を果たしているという考えを裏付けている
MERRF患者ではてんかん重積状態が発生する可能性があり, 脳卒中様発作に関連する可能性がある
MERRFとMELASやカーンズ・セイヤー症候群など, 他の表現型との重複症候群が報告
脳MRIは正常の場合もあれば, 基底核石灰化, 大脳, 小脳, 脳幹萎縮, 白質異常, 嚢胞または空胞化病変, 脳卒中様病変を示す場合もある
脳波ではミオクローヌスは棘波や多棘波として現れることがある
【POLG関連疾患】
重症度や発症年齢が異なる
POLG変異は, あらゆる年齢層におけるミトコンドリアてんかんの最も一般的な原因
臨床症状を伴う常染色体劣性POLG変異の有病率は成人10万人あたり0.3人
最も頻度の高い3つの病原性変異
c.1399G > A(p.Ala467Thr)
c.2243G > C(p.Trp748Ser)
c.2542G > A(p.Gly848Ser)
小児期に発症する表現型は, mtDNAの枯渇が原因であることが多い
アルパース・ヒュッテンロッハー症候群や筋脳肝症スペクトラム
若年期/成人期発症のPOLG関連表現型は, 典型的には複数のmtDNA欠失を特徴とし, ミオクロニーてんかん, ミオパチー, 感覚性運動失調症, 運動失調性神経障害のスペクトラムに含まれる表現型を発症する傾向がある
MELAS表現型は, 特定のPOLG変異を伴って発症することもある
成人および小児患者ともに最も一般的な発作型は焦点発作
【リー症候群(LS)】
亜急性壊死性脳脊髄症
通常は乳児期または幼児期に発症
精神運動退行または発達遅滞, 基底核および脳幹の両側特異的変化
有病率は新生児4万人に1人以上と推定
LS患者の約40%にてんかん発作が認められ, 様々なタイプの発作が現れる可能性がある
ミオクロニー発作, 焦点発作, 全般性強直間代発作が報告
【薬物療法】
コエンザイムQ10(ユビキノン)
高用量のサプリメント投与により部分的に良好な反応を示す可能性がある
リボフラビン(ビタミンB2)
ACAD9遺伝子の変異により複合体I欠損症を呈する患者は反応する可能性がある
ビオチン(ビタミンB8)またはチアミン(ビタミンB1)
LS症候群またはリー様症候群は反応する可能性がある
【抗てんかん発作薬】
非ミトコンドリアてんかんと同様に治療
ミトコンドリアてんかん患者の多くは治療抵抗性となる
バルプロ酸ナトリウム
POLG変異を有する患者では, ミトコンドリア毒性が知られている特定の薬剤を避ける(肝不全や発作増悪のリスク)
レベチラセタム
安全な治療薬とみなされており, 特にMERRFにおけるミオクローヌスの治療の第一選択薬
ベンゾジアゼピン系薬剤
クロナゼパムやクロバザムなどとの併用が可能であり, 有効性が報告
ラモトリギン
安全かつ有効であるがミオクローヌス発作を悪化させる可能性がある
ゾニサミド
一部の報告では安全な選択肢
ラコサミド
MELASまたは薬剤抵抗性発作の患者に対する優れた補助治療薬であると示されている
【非薬物療法】
迷走神経刺激 (VNS), 脳深部刺激(DBS)
薬剤抵抗性てんかんの小児患者10名において, 脳梁離断術により発作頻度が減少
【ケトン食療法】
ミトコンドリア難治性てんかんの患者に広く用いられ, 特にMELASおよびmtDNA病原性変異を持つ原発性ミトコンドリア疾患の発作抑制に安全かつ効果的であることが証明
mtDNA多重欠失に関連するミトコンドリアミオパチーの治療には禁忌
グルタミン酸濃度を低下させ神経興奮を低下させる
ミトコンドリア疾患患者(主に小児)の発作抑制に高い有効性を示したが, 症例の65%に頭痛, 無気力, 横紋筋融解症, 乳酸アシドーシスなどの副作用
中国で行われた前向きオープンラベル対照試験では, 参加者の31.8%がケトジェニックダイエット開始1か月後に50%以上の発作減少
MELASまたはmtDNA病原性変異を持つ患者でより効果的
【脳卒中様発作およびてんかん重積状態】
ベンゾジアゼピン系薬剤で迅速に治療する必要がある
レベチラセタムが推奨(20~40 mg/kg、最大4500 mg)
フェニトイン, フェノバルビタール, ラコサミドも使用できる
L-アルギニンの使用に関するエビデンスは乏しい
プロポフォールは禁忌ではない
ペランパネル, コルチコステロイド, ケタミン, 免疫グロブリン, マグネシウム注入などいくつかの代替の報告もある
[Lopriore P, Gomes F, Montano V, Siciliano G, Mancuso M. Mitochondrial Epilepsy, a Challenge for Neurologists. Int J Mol Sci. 2022;23(21):13216. Published 2022 Oct 30. doi:10.3390/ijms232113216]
コメント