ミオクローヌスは, 全身性, 局所性, 多巣性, 分節性の分布で発生
鑑別には, ジストニア, 舞踏病, バリズム, 運動チック, 機能性けいれん, 振戦など
表面筋電図: てんかん性スパズム, ミオクロニー発作, 強直発作の記事はこちら
【ミオクローヌスの神経生理】
皮質, 皮質-皮質下, 皮質下-非分節性, 分節性, 末梢性

皮質ミオクローヌスの治療
レベチラセタム, バルプロ酸, クロナゼパムがよく使用される
皮質-皮質下ミオクローヌス
ミオクローヌス発作の治療が優先され, バルプロ酸が治療の中心
皮質下-非分節性ミオクローヌス
クロナゼパムなど
分節性, 末梢性ミオクローヌス
治療に抵抗性を示すことが多い
症例によっては抗発作薬やボツリヌス注射が有効な場合がある
【ミオクローヌスの病態生理学的および病因学的分類】

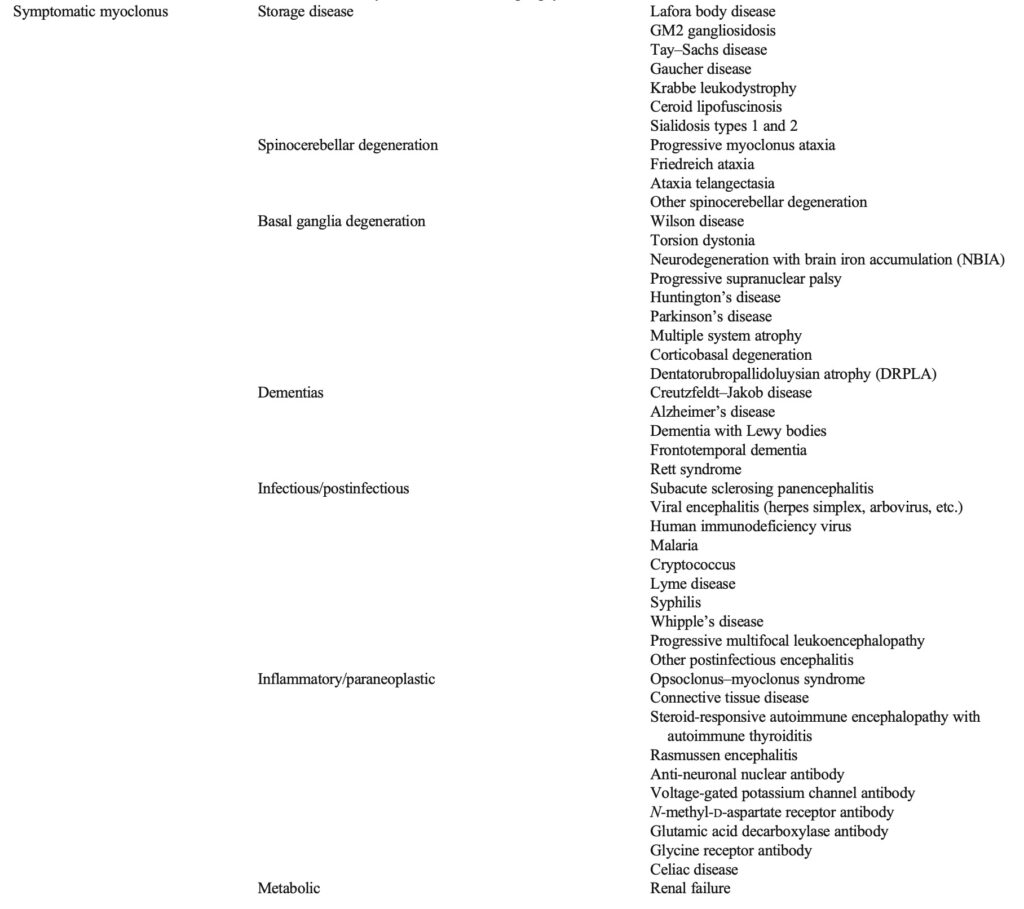

基本的な区別は,「一次性」ミオクローヌスと「二次性」または症候性ミオクローヌスを判別
さらに, 生理的ミオクローヌス, 本態性ミオクローヌス, てんかん性ミオクローヌスに分類
生理的ミオクローヌス
睡眠時反射、断片的ミオクローヌス、驚愕反応
本態性ミオクローヌス
ミオクローヌス・ジストニア症候群: 遺伝性であることが多く, 遺伝性または散発性の場合がある.
イプシロンサルコグリカン遺伝子(SGCE)の変異が関与していることが多く, 常染色体優性遺伝
てんかん性ミオクローヌス
発作の唯一の症状として発生することもあれば, てんかん症候群内の複数の発作タイプの1つとして発生することもある
症候性または二次性ミオクローヌス
毒性, 代謝性, 感染性, 炎症性, 変性性, 構造的原因など
【ミオクローヌスの神経生理学的分類】
脳波 (EEG) と表面筋電図 (EMG) があり, 同時に記録すると最も価値がある.
EEG-EMGで記録されたミオクローヌス放電は, EEG-EMG back averagingを使用して分析できる.
体性感覚誘発電位は, 特に皮質起源が疑われる場合に役立つ.
電気生理学的所見プロファイルに基づき, 皮質性, 皮質-皮質下性, 皮質下-非分節性, 分節性, 末梢性に分けられる

表面筋電図 (左: 随意運動, 右: ミオクローヌス放電)
左は, 健康な被験者が手首屈筋をできるだけ素早く短く収縮. バースト持続時間が100msを超え, 筋電図活動が徐々に増加.
右は, ミオクローヌス放電で, 持続時間が50 ms未満と短く, 立ち上がり時間が急峻

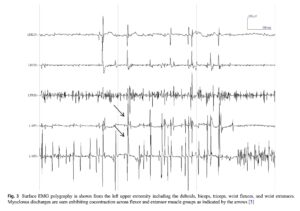
表面筋電図 (三角筋, 上腕二頭筋, 上腕三頭筋, 手関節屈筋群, 手関節伸筋群)
矢印: 屈筋群と伸筋群の共同収縮を示すミオクローヌス放電
【皮質性ミオクローヌス】
電気生理学的には, 通常50 ms未満の短い表面 EMG 放電を特徴とする
主動筋と拮抗筋の共収縮のパターンがよく見られる
安静時, 刺激時, および/または動作時に発生する可能性がある
上肢から記録した場合, EEG放電と対応する表面EMG放電との間の潜時は6~22 ms

EEG-EMG back-averaging
右手関節伸筋群からのミオクローヌス放電と, EEG (C3)
矢印: 約20msの潜時で発生するミオクローヌス放電の開始
皮質性ミオクローヌスは, 筋肉の伸張や感覚刺激などの刺激によっても誘発される場合がある.
反射性ミオクローヌスとも呼ばれる.
感覚運動野の過剰興奮性によって生じる.
giant SEPよって電気生理学的に反映
cortical reflex:
正中神経および/または脛骨神経の単回電気刺激により, ミオクローヌスEMG放電を誘発
長潜時EMG反射は, 正中神経刺激の40~60 ms後に記録
epilepsia partialis continua (持続性部分てんかん) やfocal motor seizureとして存在する可能性がある
focal motor seizureは, 通常は100 ms未満の表面筋電図放電で構成
焦点性運動発作に伴うミオクローヌスは発作的に発生するが, 10秒以内の間隔で数時間以上連続して発生する場合は, 持続性部分てんかんと呼ばれる
治療:
バルプロ酸, レベチラセタム, ブリバラセタム, クロナゼパム, ペランパネル
【皮質-皮質下ミオクローヌス】
全般てんかん症候群で最も一般的に発生
若年性ミオクローヌスてんかん (JME)が一般的
全般てんかん症候群で見られる発作は, 皮質と皮質下構造間の双方向接続から生じる
前視床皮質回路は, JMEと全般性欠神発作に関係していることが示されている
皮質-皮質下ミオクローヌス放電は, 双方向の皮質および皮質下ニューロン興奮が起こるため, 皮質ミオクローヌスと比較すると, 拡散し両側性である
一次運動野に広がるとミオクローヌスが発生し, 皮質-皮質下ミオクローヌスは, 両側性で同期していることが多い
他の構造に影響を及ぼすと, 意識消失などがミオクローヌスと同時に起こることがある
表面筋電図のミオクローヌス放電は通常短く, 50~100 ms
皮質ミオクローヌスよりも, わずかに長い可能性がある
EEG上の棘波または多棘波および波放電に時間的に同期して発生
治療:
バルプロ酸, ラモトリギン, レベチラセタム, トピラマート
【皮質下-非分節性ミオクローヌス】
ミオクローヌスの放電は持続時間が長く, 200 msに達することがよくある
基礎にあるメカニズムは様々
バルプロ酸やレベチラセタムなどは, 通常, 限定的な効果にとどまる
ミオクローヌス・ジストニア症候群
皮質下-非分節性ミオクローヌスの例としてよく知られ, 遺伝性本態性ミオクローヌスとも呼ばれる.
ゾニサミド, クロナゼパム, 脳深部刺激療法
オプソクローヌス・ミオクローヌス症候群
脳幹伝導路から生じると考えられている皮質下-非分節性ミオクローヌス
小児神経芽腫に関連する腫瘍随伴症候群が典型的
成人では, さまざまな炎症性, 感染性, 構造的原因
クロナゼパム, バルプロ酸, レベチラセタム, トピラマートなど
【網様反射ミオクローヌス】
尿毒症や低酸素症からの回復期
ミオクローヌスは, 主に上肢近位部および体幹筋に広く分布して発生し, 筋肉の活性化または驚愕によって誘発される脳波は, 伴う場合と伴わない場合がある.
低酸素症や尿毒症を背景とした網様反射性ミオクローヌスは, 基礎にある代謝異常により改善することがある
【脊髄固有ミオクローヌス】
脊髄発生器からの体幹筋のけいれんを引き起こす非分節性ミオクローヌス
脊髄の構造的病変を評価する必要がある
電気生理学的特徴は, 脊髄の特定のレベルから生じる表面筋電図放電
上肢, 下肢の筋肉が関与することもある
通常, 両側性で対称的
表面筋電図放電の持続時間はさまざまで, 300 msを超えることもある
健康なボランティアが模倣できた例もある
クロナゼパム, ゾニサミド, レベチラセタム, バルプロ酸, カルバマゼピン, バクロフェン
【分節性ミオクローヌス】
脳幹または脊髄の特定の分節から生じる
脊髄分節性ミオクローヌスは, 連続する脊髄レベルに対応する筋肉が関与することで, 他の形態のミオクローヌスと区別
分節性ミオクローヌスは, 末梢ミオクローヌスとは対照的に両側に発生することもある
表面筋電図放電の持続時間は大きく変動し, 50 msから500 msまで存在
ミオクローヌス放電は, 0.2~8 Hzの周波数で律動的
分節性ミオクローヌスは, 通常, 持続し, 意識状態, 運動活動, 感覚刺激の影響を受けない
口蓋ミオクローヌス
分節性ミオクローヌスの最も一般的な例は, 口蓋ミオクローヌス
歯状核-赤核-オリーブ核経路 (ギラン-モラレ三角)
本態性または特発性もある
耳の中で不快なクリック音がすることがある.
治療に抵抗性であることが多い.
クロナゼパム, バクロフェン, スマトリプタン, ラモトリギン, トリヘキシフェニジル, カルバマゼピンなど
ボツリヌス毒素注射
治療抵抗性の口蓋ミオクローヌスに起因する重度の耳鳴りには, 外科的介入
脊髄分節性ミオクローヌス
分節性ミオクローヌスの原因は, 構造的病変 (血管性, 腫瘍性, 炎症性, 感染性など), 特発性
薬物療法に反応しないことが多い
クロナゼパム, テトラベナジン, トリヘキシフェニジル, バクロフェン, カルバマゼピン, レベチラセタム, ボツリヌス毒素注射
【末梢性ミオクローヌス】
末梢神経系から生じる局所的なミオクローヌス
表面筋電図では, 同じ末梢神経分布から生じるさまざまな長さの放電
最も一般的な例は片側顔面けいれん
ボツリヌス毒素注射
カルバマゼピン: 35%で持続的に改善するが, 完全な緩和はまれ
ガバペンチン: 患者の69%で少なくとも70%の改善
圧迫性病変がある場合は外科的治療を考慮
片側顔面けいれんに対する微小血管減圧術を受けた患者の最大90%で良好な結果だが, 再発例もある
【機能的なjerk】
表面筋電図放電の持続時間は, 通常100 ms 以上と長い.
持続時間と分布に顕著なばらつきがみられる
ミオクローヌスに典型的な主動筋-拮抗筋の活性化パターンは機能性ジャークでも見られる
刺激誘発性ジャークでは, 反応潜時が100 msを超える場合は機能的病因が示唆される
一般的に薬物治療は適応にならない
認知行動療法, バイオフィードバック, 理学療法, 経頭蓋磁気刺激など
[Pena, Ashley B, and John N Caviness. “Physiology-Based Treatment of Myoclonus.” Neurotherapeutics : the journal of the American Society for Experimental NeuroTherapeutics vol. 17,4 (2020): 1665-1680. doi:10.1007/s13311-020-00922-6]
コメント